Projektmanagement beschleunigt medizinische Durchbrüche bei Impfstoffentwicklung
Die Entwicklung der Coronavirus-Impfstoffe durch das Konsortium BioNTec/Pfizer sowie Moderna sind zweifelsohne die wissenschaftlichen Durchbrüche des vergangenen Jahres. Während nicht-pharmakologische Maßnahmen des Abstandhaltens und Maskentragens die Pandemie bisher nur in Schach halten können, hat diese Entwicklung das Potential, eine echte Lösung dieser weltumspannenden medizinischen Krise zu sein.
In der Öffentlichkeit werden Vorbehalte gegenüber diesem neuen Impfstoff laut. Ausgelöst durch die schnelle Entwicklung, fürchten Stimmen, kein ausgereiftes Produkt zu erhalten. Dagegen empfiehlt sich ein analytischer Blick aus der Perspektive des Gesamtvorhabens. Für Projektmanagement-Experten ist klar: Diese kurze Entwicklungszeit fußt neben der Genialität der Wissenschaftler auf optimierten Prozessen und professionellem Projektmanagement.
Im Folgenden soll dargestellt werden, welche veränderten Prozesse diese erstaunliche Beschleunigung einer üblicherweise mehrere Jahre andauernden Entwicklungsarbeit ermöglicht haben.
Wiederverwendende Entwicklung
Corona-Viren, benannt nach ihren kronenartigen Proteinkränzen, sind Medizinern seit langem als Krankheitserreger beim Menschen bekannt. Europäischen und amerikanischen Gesellschaften erschien dieses Thema 2020 als beinahe völlig neuartig. Bevölkerungen asiatischer und arabischer Regionen waren diese Viren leidvoll bekannt, waren diese doch die Krankheitserreger der vorangegangenen SARS und MERS-Epidemien.
Die Erkenntnisse aus den vorangegangenen Epidemien sind ein entscheidender Baustein bei der Entwicklung des aktuellen Impfstoffes. Eine internationale Forschergruppe publizierte 2014 eine Laborstudie zur Wirksamkeit eines MERS-Impfstoffes. Die Studie zeigt auch dem medizinischen Laien auf, dass spezifische Eigenschaften der Corona-Viren bereits seit längerem bekannt sind und die Impfstoffentwicklung hierauf aufbauen kann:
„Das Spike-Protein (S) des MERS-CoV [Virus], ein charakteristisches Strukturelement der Virushülle, wird als primäres Ziel eines Impfstoffes gegen die Corona-Virus Infektion angesehen.“ [1]
Auch die Technologie der (m)RNA Impfstoffe ist keineswegs neuartig, obwohl bisher für keinen Wirkstoff eine Zulassung erreicht werden konnte. Es findet sich beispielsweise eine Studie aus dem Jahr 2009 zur Anwendung eines mRNA Impfstoffes gegen bestimmte Tumorzellen.[2]
Zusammengefasst zeigt sich: Die Wissenschaft beherrscht Wissensmanagement wie niemand sonst. Es sollte ein Beispiel für unternehmerisches Handeln darstellen.
Parallelisierung in der Studienphase
Schnelle Entwicklung war neben der Sicherheit des Impfstoffes von zentraler Bedeutung für alle beteiligten Pharmaunternehmen. Nicht umsonst nennt das Konsortium aus BIONTECH, Pfizer und Fosun, das den ersten Wirkstoff zulassen konnte, die eigene Entwicklung „Project Lightspeed“.
Die Entwicklung von Impfstoffen erfolgt nach einem standardisierten Phasenplan, der von den Überwachungsbehörden (z.B. FDA, EMA) vorgegeben ist.
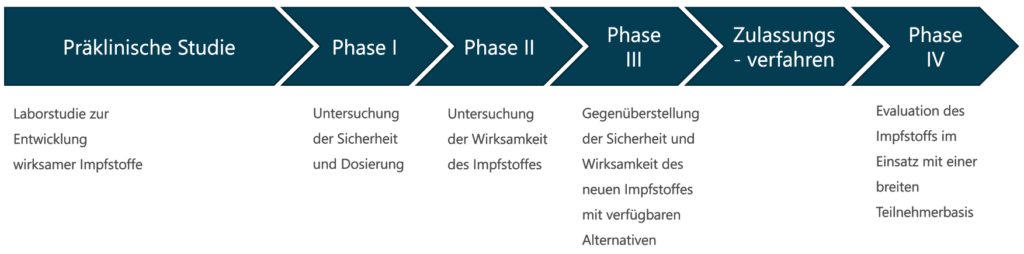
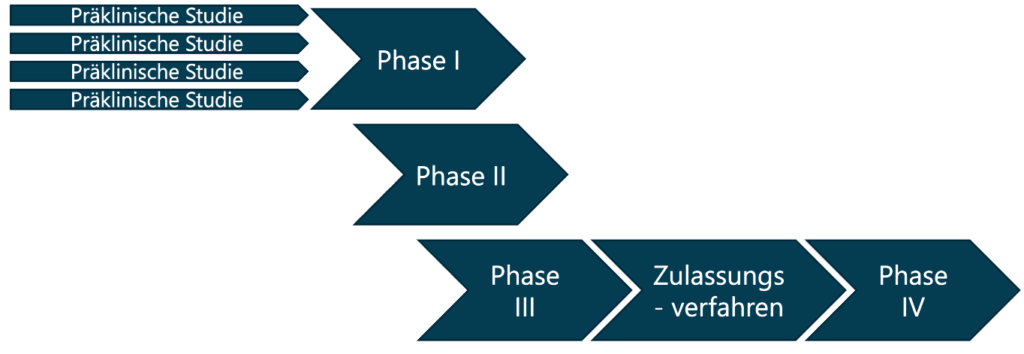
Die Beschleunigung bei der Entwicklung des Coronavirus-Impfstoffes erfolgt durch mehrere Veränderungen im Entwicklungsprozess. Üblicherweise entwickelt ein Hersteller in der präklinischen Studie nur einen Wirkstoff, der anschließend die klinischen Stufen durchläuft. In diesem Fall wurde die Phase I für mehrere potentielle Wirkstoffe parallel gestartet [4]. Vermutlich so gemeint: Die Sicherheit für die freiwilligen Studienteilnehmer wird vor Beginn der Testung am Menschen für alle Wirkstoffe gewährleistet. Dieses kostenintensive Vorgehen wurde durch die besonders hohe Verfügbarkeit von Finanzmitteln in der Pandemie ermöglicht.
Eine weitere Maßnahme zur Beschleunigung der Impfstoffentwicklung ist die Kombination der klinischen Entwicklungsphasen. Bei der Entwicklung der Coronavirus-Impfstoffe wurden vielfach die Phase I und II in sogenannten Phase I/II Studien [5] kombiniert. Hierdurch ist es möglich, die Entwicklungszeit zu verkürzen ohne die Sicherheit der Studienteilnehmer zu gefährden.
Beschleunigtes Zulassungsverfahren
Ein Ereignis von besonderer Bedeutung bei der Entwicklung eines neuen Impfstoffes ist das Zulassungsverfahren der Überwachungsbehörden. In den USA wird dies durch die FDA durchgeführt. In der EU gilt ein zentralisierter Ansatz, die Europäische Arzneimittel Agentur (European Medicines Agency, EMA) hat ihren Sitz in Amsterdam.
Beim Standard-Zulassungsverfahren erfolgt die Anmeldung durch den Entwickler des Impfstoffs nach Abschluss der Forschungs- und Entwicklungsphase. Anschließend erfolgt die Zulassung innerhalb von 210 Tagen durch die EMA.
Zur beschleunigten Zulassung zeitkritischer Impfstoffe – dies kann neben den Covid-19 Impfstoffen z.B. auch auf Krebs-Therapien zutreffen – wurde das Rolling review Verfahren geschaffen. Anders als das Standardverfahren wird dieses Zulassungsverfahren parallel zum Entwicklungsprozess begonnen. Dieses Verfahren verfolgt einen iterativen Ansatz, dies lässt sich auch bei agilen und hybriden Projektmanagement-Modellen in anderen Industrien erkennen. Der Entwickler des Impfstoffes übersendet seine Studienergebnisse zyklisch an die EMA. Diese prüft die Ergebnisse innerhalb von 14 Tagen. Hierdurch werden auf zwei Ebenen Prozessbeschleunigungen erreicht:
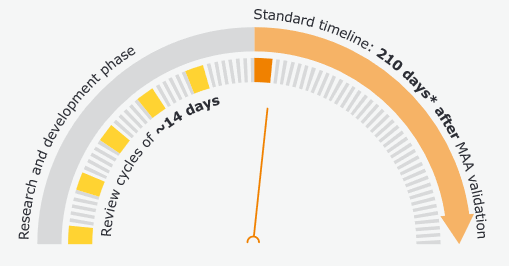
Grafik: Standard Zulassungsverfahren und Rolling Review European Medicines Agency. Fast-track procedures for treatments and vaccines for COVID-19
- Am Ende der Entwicklung kann die Zulassung sehr schnell erfolgen, da Daten und Erkenntnisse aus vorangegangenen Zyklen der EMA bereits vorliegen.
- Durch die zyklische Beurteilung durch die EMA können Abweichungen im Entwicklungsprozess frühzeitig erkannt werden. Der Entwickler des Impfstoffes kann diese Erkenntnisse – so dies nicht die Integrität der Studien gefährdet – in seine Entwicklung einfließen lassen.
Fazit
Die Entwicklung und Bereitstellung eines Coronavirusimpfstoffs war dank paralleler Projektphasen und hoher Verfügbarkeit von Finanzmitteln und Experten in kurzer Zeit möglich. Dies zeigt, dass ein optimiertes Projekt- und Prozessmanagement einen wesentlichen Beitrag zu einem ausgereiften und durchgetesteten Produkt führt.
Quellen
- Eun Kim, Kaori Okada, Tom Kenniston, V. Stalin Raj, Mohd M. AlHajri, Elmoubasher A.B.A. Farag, Farhoud AlHajri, Albert D.M.E. Osterhaus, Bart L. Haagmans, Andrea Gambotto. Imunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/c mice. Vaccine. 14, 2014, 32, S. 5975-5982. [Zitat vom Autor übersetzt]
- Weide, Benjamin, et al. Direct Injection of Protamine-protected mRNA: Results of a Phase 1/2 Vaccination Trial in Metastatic Melanoma Patients. Journal of Immunotherapy. 2009, Bd. 32, 5.
- The drucg development process. [Online] US Food and Drug Adminstration. [Zitat vom: 25. 01 2021.] https://www.fda.gov/patients/learn-about-drug-and-device-approvals/drug-development-process.
- Inc., BioNTech SE & Pfizer. Pfizer und BioNTech veröffentlichen erste positive Daten aus laufender Phase-1/2-Studie mitmRNA-basiertem SARS-CoV-2-Impfstoffkandidaten. Pressemitteilung. [Online] 01. Juli 2020. [Zitat vom: 25. 01 2021.] https://investors.biontech.de/de/node/8011/pdf.
- Mulligan, M.J., Lyke, K.E., Kitchin, N. et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 586, 2020.
- European Medicines Agency. Fast-track procedures for treatments and vaccines for COVID-19. [Online] [Zitat vom: 26. 01 2021.] https://www.ema.europa.eu/en/documents/leaflet/infographic-fast-track-procedures-treatments-vaccines-covid-19_en.pdf.